مواد مصنوعی=موادی هستند که در طبیعت وجود ندارندو با ایجادتغییراتی شیمیایی در آن در کارخانه به وجود می آید.
مواد طبیعی مانند=خاک پنبه چرم چوب سنگ.مواد مصنوعی=کیف
مواد طبیعی: هر ماده ای که در طبیعت به همان شکلی یافت شود که استفاده می شود، ماده طبیعی نام دارد مانند: اکسیژن،نیتروژن، نفت خام، ماسه، فلز طلا و...

مواد مصنوعی: موادی هستند که انسان آنها را از ماده ی موجود در طبیعت می سازد. این مواد به شکلی که وجود دارند در طبیعت یافت نمی شوند،مانند: آلومینیم، پلاستیک، مداد، شمع، شیشه و...

شناخت مواد طبیعی ومصنوعی
جهت مقایسه ساخته های طبیعی و ساخته های دست بشر چه باید کرد؟
ما ممکن است که اقلام ساخته شده از مواد طبیعی را در مقابل آن هایی که به روش های مصنوعی ایجاد شدهاند، تشخیص ندهیم. به عنوان نمونه، محصولات چوبی نظیر کاغذ از درختان ساخته شده اند. بنابراین این مواد طبیعی هستند اما خود محصول توسط بشر ساخته شده است. و لیکن پلاستیک ها از یک ترکیب شیمیایی شامل محصولات نفتی حاصل میشوند و به طور مصنوعی تولید میگردند. محصولات نفتی طبیعی هستند اما پلاستیک ها به طور شیمیایی ساخته می شوند..

آهن :
این فلز ، از سنگ معدن آهن استخراج میشود و به ندرت به حالت آزاد (عنصری) یافت میگردد. آهن برای تولید فولاد بکار میرود که عنصر نیست، بلکه یک آلیاژ و مخلوطی است از فلزات متفاوت ( و تعدادی غیر فلز بخصوص کربن ) آهن از تمامی فلزات بیشتر است و 95 درصد فلزات تولید شده در سراسر جهان را تشکیل میدهد. قیمت ارزان و مقاومت بالای ترکیب آن استفاده از آن را بخصوص در اتومبیل ها ، بدنه کشتیهای بزرگ و ساختمان ها اجتناب ناپذیر میکند.

آلومینیوم :
آلومینیوم ، فلزی نرم و سبک ، اما قوی است که عمدتاً به صورت سنگ معدن بوکسیت یافت میشود. وزن آلومینیوم تقریباً یک سوم فولاد یا مس است.ِ چکش خوار ، انعطاف پذیر و به راحتی خم میشود. همچنین بسیار بادَوام و مقاوم در برابر زنگ خوردگی است.
چه از نظر کیفیت و چه از نظر ارزش ، آلومینیوم کاربردیترین فلز بعد از آهن است و تقریبأ در تمامی بخشهای صنعت دارای اهمیت میباشد. برخی از کاربردهای فراوان آلومینیوم عبارتاند از: حمل و نقل ( اتومبیلها ، هواپیماها ، کامیونها ، کشتیها ، ناوگانهای دریایی ، راه آهن و ... ) بستهبندی ( قوطیها ، فویل و... ) ساختمان ( درب ، پنجره ، دیوار پوشها و ... ) کالاهای با دوام مصرف کننده ( وسایل برقی خانگی ، وسایل آشپزخانه ، ... )

طلا :
طلا در طبیعت معمولاً در میان سنگهای آتشفشانی و گاهی در میان رسوبات رودخانهای و دریاچهای یافت میشود.
اولین و بارزترین مشخصه ی طلا، رنگ زرد و برق فلزی آن است و به همین دلیل از آن برای ساخت جواهرات استفاده می شود.نزدیک به نیمی از طلای دنیا نزد دولت ها به صورت شمش (قطعههای طلا) نگه داری میشود.

نقره :
فلزی نرم، انعطاف پذیر با نمایی سفید و درخشان است. در مقایسه با دیگر فلزها، رسانایی الکتریکی و گرمایی بسیار بالاتری دارد. نقره فلزی غیرسمی است و به صورت گرد آتش گیر است.. از نقره برای تولید لوازم فلزی منزل، ظروف آشپزخانه، جواهرآلات و قطعات رسانا در وسایل برقی استفاده می شود.

مس :
فلزی سرخ رنگ و انعطاف پذیر است و رسانایی الکتریکی بالایی دارد. در حالت عنصری، سمی نیست و وجود مقدار ناچیزی از آن در رژیم غذایی بسیار ضروری است. از مس برای تولید سیم های برق و برخی از آلیاژها مانند برنج و برنز استفاده می شود.

روی :
فلزی سفید و درخشان است که نمای خاکستری مایل به آبی دارد؛ به صورت عنصری در طبیعت یافت نمی شود. سمیت کمی دارد وبه صورت گرد آتش گیر است. از روی برای تولید ظروف آشپزخانه ، برخی آلیاژها مانند برنج و برنز و در باتری سازی استفاده می شود.

سرب :
فلزی خاکستری رنگ، نرم، سنگین است. آتش نمی گیرد و به صورت گرد یا بخار سمی است. رسانایی الکتریکی ناچیزی دارد و امواج صوتی را به خوبی جذب می کند. از سرب برای ساختن باتری های انباره ای (باتری خودروها)، آلیاژهای لحیم کاری، روکش درونی کابل های مخابراتی و تولید برخی مواد شیمیایی به ویژه تترا اتیل سرب (برای تولید بنزین سرب دار) استفاده می شود.

جیوه :
جیوه تنها فلز مایع در دمای اتاق است سمی است و در ساخت آینهها به کار میرود. جیوه جذب شده توسط ریه وارد خون میشود و در اندام های مختلف مثل کلیه ، مغز و کبد توزیع میشود.جیوه اثراتی نیز بر قلب دارد و باعث عوارض قلبی میشود.

عناصر نافلزی
بُرم :
مایعی است به رنگ سرخ قهوه ای که بخار آن بسیار سمی و سوزش آور است. این نافلز به صورت عنصر، در طبیعت یافت نمی شود. به شدت واکنش پذیر است و به مقدار بسیار کمی در آب حل می شود. ترکیب های آن در آب دریا زیاد است و از همین منبع استخراج می شود. برم درتولید مایع های خاموش کننده ی آتش، رنگ های نساجی، مواد دارویی و عکاسی کاربرد دارد.

کلر:
گازی سمی به رنگ سبز مایل به زرد است. بویی آزاردهنده و نافذ دارد و در هوا نمی سوزد. این نافلز به صورت عنصر، در طبیعت وجود ندارد و ترکیب های آن در آب دریا و در خشکی به مقدار زیاد یافت می شود. نمک خوراکی (سدیم کلرید) و جوهر نمک (هیدروکلریک اسید)از جمله ی شناخته شده ترین ترکیب های آن هستند.
کلر در تصفیهی آب و تولید بسیاری از مواد شیمیایی، به ویژه پیویسی کاربرد دارد. پی وی سی نوعی ماده ی پلاستیکی است که برای تولید بطری های نوشابه، لوله های انتقال آب و ... به کار می رود.

یُد :
ید نافلزی بسیار سمی است که از ترکیبات آن در پزشکی (تشخیص و تنظیم میزان فعالیت غده ی تیروئید و درمان بیماری گواتر) و عکاسی (ساخت ماده ی حساس به نور) استفاده می شود. این نافلز نیز به صورت عنصر آزاد در طبیعت یافت نمی شود.
در صورت کمبود ید در بدن بیناری گوآترایجاد می گردد که برای پیشگیری از این بیماری مصرف نمک ید دار توصیه می شود.

گوگرد :
جامدی غیر سمی به رنگ زرد است و به آسانی و با تولید گازی بی رنگ، سمی و خفه کننده (گوگردیاکسید) در هوا می سوزد. این نافلز به فراوانی، به صورت عنصر در طبیعت وجود دارد. مقادیر زیادی از آن در اطراف چشمه های آب گرم و مناطق آتش فشانی و به مقدار بسیار زیاد در معادن زیرزمینی، گاز طبیعی ترش و گاز کوره های کک پزی یافت میشود.
از گوگرد برای تولید سولفوریک اسید، مواد آرایشی بهداشتی، مواد منفجره، حشره کش ها، رنگ های نساجی، مواد شوینده و لاستیک خودروها استفاده می کنند.

کربن :
نافلزی است که به چند شکل در طبیعت یافت میشود. الماس و گرافیت دو شکل بلوری آن هستند و زغال، کک و دوده (کربن سیاه حالت های بیشکل یا غیر بلوری آن به شمار می آیند. کاربردهای کربن به شکل آن بستگی دارد؛ برای نمونه از دوده در تولید لاستیک خودروها، جوهر مشکی، کاغذهای کربن مشکی و واکس سازی استفاده می شود.

فسفر سرخ :
فسفر به صورت عنصر، در طبیعت یافت نمیشود و ترکیب های آن به صورت سنگ های فسفاتی فراوان است. فسفر به سه شکل فسفر سفید، فسفر سیاه و فسفر سرخ وجود دارد. فسفر سرخ، گرد بی شکلی است به رنگ سرخ بنفش و با سمیت کم. مقدار زیاد آن در برابر هوا خود به خود آتش می گیرد. از این نوع فسفر در تولید فسفریک اسید، کبریت های بی خطر و کودهای شیمیایی استفاده می شود.

عناصر شبه فلزی
شبه فلز : عناصری که خواص آنها از بین فلز و نافلز قرار می گیرد شبه فلز نامیده می شوند. عناصری مانند: سیلیسیم و آرسنیک جزء شبه فلز ها محسوب می شوند.
آرسنیک :
آرسنیک ، شبه فلز سمی معروفی است و از نظر شیمیایی شبیه فسفر است، که به سه شکل زرد ِ سیاه و خاکستری یافت میشود. آرسنیک و ترکیبات آن ، بعنوان آفتکش(علف کش ، حشره کش) مورد استفاده قرار میگیرند
آرسنیک و بسیاری از ترکیبات آن سمی هستند. آرسنیک با مختل کردن وسیع سیستم گوارشی و ایجاد شوک ، منجر به مرگ میشود
.

سیلیسیم :
سیلیسیم عنصری غیرفلزی است که در طبیعت به صورت خالص یافت نمیشود. سیلیسیم خالص، ماده ای سخت به رنگ خاکستری تیره است. این ماده مانند فلزات میدرخشد. سیلیسیم در حرارت بالا با سایر عناصر ترکیب میشود.
28 درصد از پوسته زمین را سیلسیم تشکیل میدهد. سیلیسیم و ترکیبات آن در صنایع مختلف کاربرد های فراوان دارند. مثلاً در صنایع الکترونیک و شیشه سازی
در این پست اطلاعاتی در مورد برخی از فلزات و نافلزهایی که در طول روز با آن ها سر و کار دارید و همچنین کاربرد های هریک از آن ها قرار داده شده است . سپس خواهید دانست شبه فلزات چیست و چه ارتباطی با فلزات و نافلزات دارد و با مثال ها ی آن نیز آشنا می شوید
فلزات مورد بررسی : آهن ، آلمینیوم ، طلا ، نقره ، مس ، روی ، سرب و جیوه
نافلزات مورد بررسی : بُرم ، کلر ، یُد ، گوگرد ، کربن و فسفر سرخ
شبه فلزات مورد بررسی : آرسنیک و سیلسیم

زات گروه VA
فلزات این گروه عبارتند از آنتیموان و بسیموت
آنتیموان فلزی به رنگ سفید مایل به آبی است این فلز چکش خوار ونرم نیست ورسانای ضعیفی برای جریان برق است . آنتیموان گاهی غیر فلز معرفی می شود ولی در کانی شناسی شبه فلز نامیده می شود کاربرد عمده آنتیموان در آلیاژهاست .
بسیموت فلزی به رنگ سفید مایل به خاکستری با زمینه قرمز است که گاه به شکل طبیعی درمقادیر کم یافت می شود این فلز یکی از معدود فلزاتی است که حجم آن هنگام انجماد افزایش می یابد هنگام تغییر از حالت مایع به جامد به میزان 32/3 درصد منبسط می شود بیسموت به عنوان عامل آلیاژ دهنده کاربردهای متنوعی دارد .
هر دوی این فلزات بسیار تردند و به سهولت به گرد تبدیل می شوند .
عناصر واسطه
عناصر واسطه بین گروههای IIIA , IIA در شکل طویل جدول تناوبی قرار دارند . سومین و چهارمین ردیف عناصر واسطه که به ترتیب شامل لانتانیدها و آکتینید می باشند ، عناصر واسطه داخلی نامیده می شوند .
کلیه عناصر واسطه فلز می باشند بسیاری از فلزات واسطه ، مخصوصا اولین ردیف این عناصر فلزات فعال هستند . این فلزات به طور کلی دارای نقاط ذوب و جوش و تبخیر بالایی هستند عناصر گروهII B ( روی کلادمیم وجیوه ) ازاین قاعده کلی مستثنی هستند جیوه در شرایط عادی مایع است وهمه عناصر این گروه نقطه ذوب نسبتا پایینی دارند و تبخیر آنها نسبتا آسان است اکثر فلزات واسطه رسانای خوب گرما و برق هستند عناصر گروه IB از این جهت وضع ممتازی دارند البته میل ترکیبی عناصر این گروه بسیار کم است به طوری که در طبیعت غالبا به حالت آزاد یافت می شوند .
فلزات گروه IB
فلزات این گروه عبارتند از مس ، نقره ، طلا
مس در طبیعت به مقدار زیاد به حالت آزاد یافت می شود و به همین علت از جمله نخستین فلزاتی است که مورد استفاده بشر قرار گرفته است این فلز به صورت ترکیب نیز در طبیعت وجود دارد مس را معمولا با حرارت دادن اکسید یا کربنات آن درزغال استخراج می کنند این فلز رنگ سرخی دارد و پس از نقره بهتر از تمام فلزات گرما و برق را از خودعبور می دهد .
نقره فلزی سفید و درخشنده و صیقل پذیراست که نوررا به خوبی منعکس می کند به همین جهت در ساختمان آینه ها به کار می رود ( آینه ورقه نازکی از نقره است که به وسیله یک صفحه شیشه نگه داری می شود ) نقره خالص از مس نرمتر واز طلا
سخت تر است نقره گرما و برق را بهتر از تمام فلزات از خود عبور می دهد .
طلا معمولا در طبیعت به حالت آزاد یافت می شود این امر نشان دهنده میل ترکیبی بسیار کم آن است .
طلای خالص ، نرم و بسیار سنگین است و قابلیت چکش خواری و مفتول شدن آن از تمام فلزات بیشتر است طلا تنها فلز زرد رنگ است .
فلزات گروه IIB
فلزات این گروه عبارتند از روی ، کادمیم و جیوه .
روی در طبیعت به حالت آزاد وجود ندارد و معمولا به صورت ترکیب یافت میشود روی را از طریق استخراج آن از سنگ معدنهایش به دست می آورند . قطب منفی بیشتر پیلهای الکتریکی را از روی می سازند .
مهمترین مصرف روی در تهیه آهن سفید ( آهن گالوانیزه ) است آهن سفید را از طریق فرو بردن ورقه های آهن در روی گداخته یا از طریق آبکاری الکتریکی به دست می آورند .
کادمیم فلزی سفید رنگ است که در طبیعت به صورت سولفید کادمیم ( Cds) و جود دارد این فلز چون به سختی زنگ می زند برای حفظ آهن و فولاد به کار می رود.
جیوه معمولا به حالت آزاد در طبیعت یافت نمی شود . مهمترین سنگ معدن آن شنگرف نام دارد شنگرف را در مجاورت هوا حرارت می دهند ، جیوه بخار شده در خارج از کوره به مایع تبدیل می شود بخارات جیوه زهر آگین هستند به همین علت بیشتر سعی می کنند استخراج این فلز از راه تجزیه الکتریکی صورت گیرد . تمام فلزها( به غیر از آهن ، نیکل و پلاتین ) در جیوه حل می شوند و آلیاژی به نام ملقمه تشکیل می دهند جیوه در وسایلی از قبیل ترموستر و دماسنج ودر دندانسازی برای ملقمه کردن آمالگام به کار می رود . از بخار جیوه برای چراغهای فلورسان استفاده میشود .
فلزات گروه III B
فلزات این گروه عبارتند از اسکاندیم ، ایرتیم ، لانتان و آکتینیم
اسکاندیم و ایتریم به یکدیگر خیلی شبیهند اسکاندیم فلزی به رنگ سفید نقره ای است این فلز عنصر نادری نیست ولی با این حال اطلاعات نسبتا کمی در مورد شیمی آن وجود دارد اتیریم دارای جلای نقره ای است این فلز تا دمای 400 درجه سانتیگراد درمقابل خوردگی مقاومت می کند .
بعداز لانتان چهارده عنصر دیگر وجود دارند که در قسمت پایین جدول تناوبی
نشان داده شده اند این گروه عناصر را که لانتان سردسته آنهاست . عناصر لانتانید مینامند . کلیه عناصر لانتانید فلزند این فلزات عبارتند از لانتان ، سریم ، پرازئودیمیم ، نئودیمیم ، پرومتیم ، ساماریم ، اورپیوم ، گادولینیم ، تربیم ، دسپروزیم ، هولمیم ، اربیم، تولیم ، ایتربیم ، و لوتسیم .
کلیه لانتانیدها به رنگ سفید نقره ای و بسیار واکنش پذیرند . ترکیبات این عناصر را مغناطیس وبه شدت رنگی هستند این عناصر به خاطر تشابه زیادی که از نظر شیمیایی دارند در طبیعت باهم یافت می شوند به جدا سازی این عناصر فوق العاده مشکل است وبرای این کار تبلور ، مکرر جزء وفنون تبادل یون به کاربرده شده اند .
بعد از آکتینیم نیز چهارده عنصر دیگر وجود دارند که در قسمت پایین جدول تناوبی نشان داده شده اند این گروه عناصر را که سر دسته آنها آکتینیم است عناصر اکتینید می نامند کلیه عناصر آکتینید فلزند این فلزات عبارتند از آکتینیم ،توریم ، پروتاکتینیم ، اورانیم ، نپتونیم ، پلوترنیم ، آمریسیم ، کوریم ، برکلیم ، کالیفرنیم ، اینشتینیم ، فرمیم ، مندلویویم ، نوبلیم ،و لاورنسیم .
از این عناصر تنها آکتینیم ، توریم و پروتاکتینیم و اورانیم در طبیعت یافت میشوند بقیه آنها در آزمایشگاه سنتز می شوند .
لانتانیدها و آکتینیدها را عناصر واسطه داخلی می نامند .
فلزات گروه IV B
فلزات این گروه عبارتند از تیتانیم ، زیر کونیم ، وهافنیم .
تیتانیم فلزی نقره ای رنگ است که در انواع زیادی از کانیها یافت می شود رسانایی الکتریکی آن کم و مقاومت ویژه الکتریکی آن زیاد است تیتانیم از معدود فلزاتی است که می تواند به چند شکل بلور تشکیل دهد .
زیرکونیم فلزی به رنگ سفید نقره ای است این فلز استحکام زیادی ندارد ولی در برابر حرارت و خوردگی مقاوم است . زیرکونیم وهافنیم از نظر خواص فیزیکی و شیمیایی آن قدر به یکدیگر شبیه هستند که زمانی مخلوط این دو عنصر را یک عنصر تصور می کردند جدا کردن این دو عنصر از یکدیگر بسیار مشکل است .
فلزات گروه V B
فلزات این گروه عبارتند از وانادیم ، نیوبیم و تانتال .
خصوصیات کلی شیمی این فلزات مشابه خصوصیاتی کلی فلزات گروه IV B است .
وانادیم فلزی خاکستری رنگ با جلای نقره ای است که به عنوان عامل آلیاژ دهنده در فولادها استفاده می شود این فلز قابلیت مفتول شدن و استحکام کششی آلیاژ را بالا
می برد .
نیوبیم فلزی به رنگ سفید با ته رنگ زرد است این فلز دردماهای نزدیک به صفر مطلق همه مقاومت الکتریکی خود را از دست می دهد واز این جهت دارای اهمیت قابل ملاحظه ای است .
تانتال فلزی سفید رنگ وبراق شبیه پلاتین است این فلز تحت تاثیر مواد شیمیایی قرار نمی گیرد ، قابلیت مفتول شدن آن زیاد است ودر دماهای بالا خواص مکانیکی خوبی دارد .
نیوبیم و تانتال که معمولا در طبیعت باهم یافت می شوند ، خواص فیزیکی و شیمیایی مشابهی دارند جدا کردن وتهیه این دو عنصر به صورت خیلی خالص بسیار مشکل است .
فلزات گروه VI B
فلزات این گروه عبارتند از کروم ، مولیبدن ،تنگستن
کلیه این فلزات سخت هستند ودر مقابل خوردگی مقاوم می باشند وبه صورت فلزات خالص و همچنین به صورت عوامل آلیاژ دهنده کاربردهای متنوعی دارند دراین گروه مولیبدن و تنگستن به طور قابل ملاحظه ای به یکدیگر شبیه هستند .
کروم فلزی براق وبه رنگ سفید با ته رنگ آبی است کورم همواره به وسیله یک لایه نازک اکسید کروم ( Ca2O3) III حفاظت میشود ( علت مقاومت آن در برابر خوردگی همین امر است ) این فلز به صورت یک پوشش محافظ وتزئینی برای سایر فلزات به کار برده می شود در آلیاژهایی مانند فولاد زنگ نزن کروم برای مقاوم کردن جسم در برابر خوردگی مورد استفاده قرار می گیرد این فلز علاوه برترکیبات فلزی ،ترکیبات نافلزی هم دارد مانند کروماتها .
تنگستن فلزی سخت خاکستری رنگ و سنگین است مولیبدن به رنگ سفید نقره ای است نقاط ذوب این دو فلز فوق العاده بالاست به همین علت از آنها در مواردی که دماهای بالا مورد نیازند استفاده می شود مانند لامپهای پرتوایکس ،لامپهای الکترون ،کوره های الکتریکی رشته های لامپهای برق .
فلزات گروه VII B
فلزات این گروه عبارتند از منگنز ، تکنسیم ، ورنیم .
منگنز فلزی به رنگ سفید نقره ای است که از تمام عناصر این گروه مهمتر و فراوانتر است این فلز در برابر خوردگی بسیار مقاوم است وبه همین علت کاربرد اساسی آن به عنوان یک ماده افزودنی در فولادها می باشد منگنز در هوا به آسانی اکسید می شود این فلز درخواص شیمیایی شباهت کاملی به آهن دارد .
تکنسیم فلزی نقره ای رنگ است که در طبیعت یافت نمی شود این فلز تنها عنصر واسطه است که در آزمایشگاه سنتز می شود کلیه ایزوتوپهای تکنسیم رادیو اکتیو دارای نیم عمر نسبتا کوتاه می باشند .
رنیم فلزی سخت به رنگ سفید نقره ای است که کاربردهایی در تکنولوژی دمای بالا دارد این فلز به مقدار کم در بسیاری از کانی ها یافت می شود .
فلزات گروهVIII B
فلزات این گروه عبارتند از آهن ، کبالت ،نیکل ، روتنیم ، رودیم ، پالادیم ، اسمیم، ایریدیم و پلاتین .
آهن فلزی به رنگ خاکستری است که مهمترین و مفید ترین فلزها و پس از آلومینیم فراوانترین فلز قشر زمین می باشد ترکیبات این فلز در طبیعت بیشتر اکسید ، سولفید ، یا کربنات هستند آهن رااز همین ترکیبات استخراج می کنند . از مخلوط کردن آهن مذاب با فلزاتی مثل منگنز یاکرومو سپس جامد کردن آن ، فولادها به دست می آیند که در صنعت استفاده فراوانی دارند چون نیز از مخلوط کردن آهن با کربن به
دست می آید و در تهیه فولاد از آن استفاده می شود .
کبالت فلزی سفید با ته رنگ صورتی است این فلز از آهن سخت تر است ودر خواص شیمیایی به نیکل شباهت دارد جز آنکه در اسیدها بهتر حل می شود و خیلی دیرتر با اکسیژن واکنش می دهد ( اکسید می شود )
نیکل فلزی به رنگ سفید مایل به نقره ای با ته رنگ زرد است این فلز بسیار محکم صیقل پذیر و چکش خوار می باشد .
از کبالت و نیکل برای آبکاری فلزات وتهیه همجوشهای کروم و تنگستن استفاده می شود این دو فلز در تهیه بوته های آزمایشگاه و افزارهای بسیار محکم و همچنین در تهیه بعضی اقسام فولاد به کار می روند .
روتنیم ، رودیم ، پالادیم ، اسمیم ، ایریدیم ، وپلاتین فلزاتی سنگین ودیرگداز هستند و میل ترکیبی کمی دارند این عناصر فلزاتی نسبتا نادر هستند وبه طور کلی در مقابل اثر مواد شیمیایی مقاومند این فلزات ازنظرظاهر فیزیکی و خواص مکانیکی کمی باهم اختلاف دارند . روتیم و اسمیم فلزاتی شکننده وخاکستری رنگ وبسیار سخت هستند رودیم ، و ایریدیم از نظر ظاهری سفید رنگ می باشند رودیم نسبتا نرم و مفتول شدنی است درحالی که ایریدیم سخت و شکننده است پالادیم و پلاتین سفید رنگند ، درخشندگی قابل ملاحظه ای دارند ونرمتر وچکش خوار تر از اسمیم ، ایریدیم ، رودیم و روتنیم ، می باشند از نظر چکش خواری پالادیم و پلاتین مشابه نقره و طلا هستند و در جدول تناوبی مجاور آنها قرار دارند .
جدول تناوبی
اهمیت جدول تناوبی برای یک شیمیدان به اندازه اهمیت نقشه برای یک توریست است . این جدول تمام خصوصیات شیمیایی و فیزیکی عناصر را به نظم در آورده است و عملا از روی محل قرار گرفتن عناصر می توان به خصوصیات فیزیکی و شیمیایی آنها پی برد .
ستونهای عمودی عناصر درجدول تناوبی ، گروه یاخانواده نامیده می شوند در جدول تناوبی هجده ستونی ، گروه اول سمت چپ مربوط به فلزات قلیایی است که نمونه آشنای آنها سدیم و پتاسیم می باشد دومین گروه جدول تناوبی مربوط به فلز ات قلیایی خاکی است که نمونه آشنای آنهامنیزیم و کلسیم می باشد .
ردیفهای افقی عناصر درجدول تناوبی ، دوره نامیده می شوند جدول تناوبی میرساند که هریک از دوره های این جدول ( به جز دوره اول که شامل هیدروژن و هلیم است ) با یک فلز قلیایی شروع می شود به یک گاز نجیب ختم می گردد .
به طور کلی عناصر جدول برحسب خصوصیاتی از قبیل هدایت الکتریکی و جلا به سه دسته فلزات غیر فلزات و شبه فلزات تقسیم می شوند خواص فلزی در جدول تناوبی از بالا به پایین افزایش واز چپ به راست کاهش پیدا می کند برای نشان دادن نظام افقی ، عناصر سومین تناوب ، یعنی از سدیم تا آرگون را درنظر می گیریم سه عنصر اول دراین تناوب ( سدیم ،منیزیم ، آلومینیم ) فلزاتی با رسانایی الکتریکی بالا هستند بعد از این سه عنصر ، یک شبه فلز یعنی سیلیسیم که یک نیمه رساناست وجود دارد چهار عنصر آخر که در سمت راست تناوب قرار دارند ( فسفر ، گوگرد ، کلر ) غیر فلز ورساناهای ضعیفی هستند نظام عمودی به وسیله گروه IV A نشان داده می شود از بالای گروه شروع می کنیم ابتدا غیر فلز کربن ، سپس د و شبه فلز سیلیسیم و ژرمانیم وجود دارند دو عنصر آخر این گروه قلع و سرب هستند که خاصیت فلزی بارزی دارند .
| روه | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
| ردیف | ||||||||||||||||||||
| 1 | 1 H | 2 He | ||||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | ||||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | ||
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | ||
| 6 | 55 Cs | 56 Ba | * | 71 Lu | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn | |
7 | 87 Fr | 88 Ra | ** | 103 Lr | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Uuu | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo | |
| * لانتانیدها | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | ||||||
| ** آکتینیدها | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No | ||||||
| قلیائی فلزیها | قلیائی خاکیها | لانتانیدها | آکتینیدها | فلزات انتقالی |
| فلزات ضعیف | شبه فلزات | غیر فلزات | هالوژنها | گازهای کامل |



سولفوریک اسید
|
نام |
اسید سولفوریک |
|
فرمول شیمیایی |
H2SO4 |
|
ظاهر |
مایع شفاف ، بی رنگ و بی بو |
|
وزن مولکولی |
۹۸ gr/mol |
|
نقطه ذوب |
۱۰ درجه سانتیگراد |
|
نقطه جوش |
۳۳۷ درجه سانتیگراد |
|
دانسیته |
۱٫۸ gr/m3 |
سولفوریک اسید برای اولین بار توسط دانشمند ایرانی زکریای رازی در قرن نهم کشف گردید.اون این ماده را از طریق تقطیر خشک کانی هایی که شامل سولفات آهن (زاج سبز) و سولفات مس (کات کبود) بودند به دست آورد.بعد ها افراد دیگری مانند جان گلوبر ، جان روبک و جوزف گیلوساک روش های دیگری را برای تولید این ماده ارائه دادند.امروزه اسید سولفوریک در صنعت و تولید مواد شیمیایی مختلف کاربرد دارد بنابراین نیاز به روشی برای تولید بالا و مقرون به صرفه این ماده است.از واکنش SO3 با آب می توان اسید سولفوریک تولید کرد اما این روش به دلیل گرمازا بودن واکنش و وجود مشکلات در کنترل واکنش عملی نیست از این رو برای تولید این ماده از روش تماسی در مجاورت کاتالزور استفاده می شود.
در روش تماسی برای جلوگیری از مسموم شدن کاتالیزور مورد استفاده و قابلیت استفاده مجدد از آن که باعث کم شدن هزینه ها می شود ابتدا باید سولفیت و هوا را خالص کرد.از واکنش گوگرد با اکسیژن SO2 حاصل می شود:
S(s)+O2(g)—– >SO3(g)
در این مرحله در مجاورت کاتالیزور SO3 تشکیل می شود:
SO2(g)+O2(g)—– >2SO3(g)
این واکنش در دمای معمولی سرعت پایینی دارد به همین منظور واکنش را در محیطی با دمای ۴۰۰ تا ۷۰۰ درجه سانتیگراد انجام می دهند و برای واکنش از کاتالیزور وانادیم پنتوکسید (V2O5) استفاده می شود.
حال SO3 را به اسید سولفوریک غلیظ وارد می کنند که از این واکنش پیرو سولفوریک اسید بدست می آید:
H2SO4(l)+SO3(g)—– >H2S2O7(l)
اگر به پیرو سولفوریک اسید مقدار مشخصی آب اضاف گردد اسید با غلظت مورد نظر حاصل می شود:
H2S2O7(l)+H2O(l)—– >2H2SO4(l)
ویژگی های سولفوریک اسید:
سولفوریک اسید ، اسیدی معدنی و بسیار قوی است که به طور طبیعی در گازهای خارج شده از آتشفشان وجود دارد و با هر درصدی در آب حل می شود.واکنش آن با آب به شدت گرمازا است به همین دلیل باید از اضاف کردن یک باره ی آب به آن اجتناب کرد.اسید سولفوریک میل ترکیبی زیادی با آب دارد به طوری که در واکنش با سایر مواد هیدروژن و اکسیژن آن ها را با صورت آب جدا می کند.اسید سولفوریک خورنده است و قسمت عمده ای از باران اسیدی را تشکیل می دهد.قطرات آب به هنگام بارش با آلاینده های کارخانه ها و خودرو ها که در هوا معلق هستند واکنش می دهند و تولید اسید می کنند.اسید سولفوریک با فلزات واکنش می دهد و هر چه دما بالاتر رود میزان این واکنش بیشتر خواهد شد اما بر روی جیوه و سرب تاثیری ندارد.اسید سولفوریک در لیست مواد خطرناک قرار گرفته است.
اسید سولفوریک دارای ویژگا های مهمی است که باعث با اهمیت شدن آن گردیده است.برخی از این ویژگی ها عبارتند از:
· عاملی خوب برای جذب آن
· هزینه پایین نگه داری و انتقال آن
· آمادگی برای تشکیل سولفات های آلی
· مطابقت با فرایند های اسیدی و خنثی سازی
· دارا بودن نقطه جوش بالا و در نتیجه امکار کار با آن در دماهای بالا
کاربرد های سولفوریک اسید:
· کاربرد در واکنش ها و فرایند های شیمیایی
· تولید کود های شیمیایی
· استخراج فلزات
· سنتز های شیمیایی
· تصفیه پساب ها
· فرایند های نیتروژن دار کردن
· تولید مواد منفجره مانند TNT و نیتروگلیسیرین
· به عنوان محلول الکترولیت در باطری های سربی وجود دارد
علائم حفاظتی:
محرک و خورنده

لوزی آتش اسید سولفوریک:
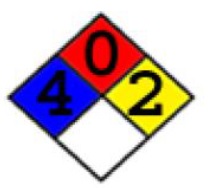
سلامتی
در تماس های کوتاه سبب مشکلات جدی و حتی مرگ می شود و نیاز به مراجعه پزشک است .
یک ماده سرطان زا ، جهش زا و یا با قایلیت تاثیر روی جنین انسان که قطعیت آن ثابت شده باشد یا مضنون به ایجاد این موارد در انسان باشد .
مشتعل شوندگی
نمی سوزد
واکنش پذیری
در شرایط سخت شیمیایی و در دما و فشار بالا منفجر می شود. با آب به شدت واکنش می دهد و یا روی آن منفجر می شود
عوارض جانبی
اسید سولفوریک با تمامی خواص و مزایای خود ماده ای خطرناک است و می تواند خسارات جبران ناپزیری را بر بدن وارد نماید.تماس آن با پوست منجر به سوزش و زخم شدن آن موضع می گردد و اگر وارد دهان شود آثار دائمی را بر جای خواهد گذاشت و همچنین باعث اسهال و استفراغ و درد شکمی و سوراخ شدن معده خواهد شد..تماس آن با چشم در اغلب موارد موجب کور شدن فرد می شود و در اثر تنفس آثاری مانند سرگیجه ، سردرد ، کاهش تنفس ، تحریک بینی و گلو و خشکی ریه مشاهده خواهد شد.در صورت تماس با بدن باید فورا با آب و صابون و محلول بی کربنات سدیم ۱ درصد شسته شود.
تجهیزات حفاظت فردی
در کارگاه و محل کار بهترین راه ایمنی کارگران استفاده از وسایل حفاظت فردی است. کارفرما باید محیط کار را در رابطه با مواد خطرناک ایمن سازد و آموزش های لازم در مورد خطرات و نحوه کنترل عوارض مواد شیمیایی به کارکنان و کارگران داده شود. همچنین باید کارگران در مورد نحوه استفاده از وسایل حفاظت فردی توجیه شوند. برای جلوگیری از تماس پوست با اسید باید از دستکش های ضد اسید استفاده کرد. تجهیزات حفاظتی به طور کلی شامل لباس کار، دستکش و چکمه است. جنس پوشش های مورد استفاده بهتر است از PVC یا پلی ونیل کلراید باشد. برای حفاظت از چشمها هنگام کار با مواد شیمیایی خورنده و سمی استفاده از عینک ایمنی یا پوشش های مخصوصی که کل صورت را می پوشاند توصیه می شود. بهترین راه برای حفاظت از سیستم تنفسی استفاده از ماسک می باشد. اما استفاده غلط از ماسک ها خود می تواند منجر به صدمات جبران ناپذیری شود. استفاده صحیح از این تجهیزات نیاز به آموزش صحیح دارد. در محیطهایی که غلظت آلاینده از ۰٫۱ میلی گرم در متر مکعب بیشتر است استفاده از ماسک هایی که کل صورت را می پوشاند توصیه می شود.

گوگرد را همه به خوبی می شناسیم. گوگرد عنصری است سفید رنگ که به صورت طبیعی در معادن زیرزمینی یافت می شود و عجیب این که این عنصر به طرز شگفت انگیزی با زندگی همه ی ما عجین شده است. البته منظور تاثیرات آتش زایی آن نیست بلکه اثرات درمانی آن بر روی بدن ما است. البته هیچ گاه گوگرد در گذشته به صورت خالص یا ضماد برای مشکلات پوستی به کار نرفته است اما اگر ازچشمه های آب معدنی حرفی به میان بیاید کمتر کسی است که یک بار بدن خود را به دست توانای آن ها نسپرده باشد. ممکن است شما جزء آن دسته اشخاصی باشید که به این مسائل اعتقاد ندارند و یا اصولا موقع بیمار شدن به دکتر مراجعه می کنند اما حتما یک بار برای تفریح هم که شده به همراه خانواده سری به این چشمه ها زده اید و دعای خیر مادربزرگ و پدربزرگ تان را برای خود خریده اید.

آری گوگرد از دیرباز درمان بخش بیماری ها بوده است و کم نبودند کسانی که هر ماه به صورت منظم در این چشمه ها ساعتی را لم می دادند و همراه با ماساژ و حرکات آرام دست ها، پاها و کمر، به درمانآرتروز مفاصل و خشکی و سفتی عضلات شان کمک می کردند آن ها می دانستند که با این برنامه ی منظم خواهند توانست چند هفته و یا حتی چند ماهی از این دردهای طاقت فرسا رهایی یابند. پس رنج سفر را به جان می خریدند و تپه ها و کوه های صعبالعبور را پشت سر گذاشته و فرد را به این چشمه های آب گرم می رسانیدند. جالب تر آن که این افراد معمولا از وجود گوگرد و تاثیرات معجزه آسای آن خبر نداشتند و تنها وجود این آب زلال و گرم که از دل کوه ها می جوشید را سکوی درمان خود می پنداشتند.
برخی نیز پا را فراتر گذاشته و این آب را حاصل انرژی های درون زمین می دانستند. اولین کسی که شاید در تاریخ طب پرده از این راز برداشت " ساموئلهانمان " آلمانی بود. شاید قبل از او نیز دیگر پزشکان به این تاثیرات درمانی گوگرد پی برده بودند اما این " هانمان " بود که توانست گوگرد را تخلیص کرده و آن را به صورت خوراکی در درمان بیماری های خاص به کار برد.
یکی از خواص معجزه آسای گوگرد، درمان بیماری های پوستی و به خصوص بثورات، خارش، کهیر و تورم هایی بود که به بروز جوش و تاول منجر می شد. او به تجربه دریافت این بثورات به ظاهر ساده و کم اهمیت در صورتی که به درستی درمان نشوند قادر هستند طی سال های بعد فرد را به بیماری های جدی تری مبتلا سازند. توجیه او در این زمینه با توجه به دانش آن روز بسیار جالب توجه بود. او اعتقاد داشت بدن ما از چند لایه تشکیل شده است که درونی ترین و مرکزی ترین این لایه ها همان جان ما است و پس از آن به ترتیب لایه هایی نظیر فکر، منطق، احساسات و پس از آن مغز، قلب، استخوان ها، عضلات و ... قرار دارند. خارجی ترن لایه نیز پوست ما می باشد.

به این ترتیب تمامی عوامل بیماری زا برای این که بتوانند فرد را بیمار کنند باید جان او را گرفتار کنند. اما جان، تمامی مصائب و مشکلاتش را به صورت علائم جسمی و روحی بروز می دهد. او اعتقاد داشت بدن ما قادر است بیماری ها را از ارگان های پُراهمیت تر به اندام های کم اهمیت تر انتقال دهد. بنابرین خطر کمتری بدن را تهدید خواهد کرد. به طور مثال وقتی کسی دچار شوک روحی روانی می شود این شوک می تواند باعث ایست قلبی یا مغزی او شود. اما بدن ما این شوک را به پوست سر منتقل کرده و تکه ای از موها به صورت سکه ای ریزش می کنند، این جا است که فرد از مرگ حتمی نجات پیدا می کند اما یک تکه از موهایش می ریزد. بنابراین برای درمان بیماری های پوست و مو باید ریشه ی بیماری را از اندام های داخلی تر و یا روح و روان بیمار جستجو کرد.
اما متاسفانه خیلی از پزشکان عادت دارند وقتی بیماری با مشکلات پوست و مو مراجعه می کند، بیماری او را به صورت نامناسبی سرکوب کرده و بیمار را به صورت موقتی از مشکلات سطحی اش خلاص می کنند غافل از این که بدن که در تخلیه مصائب درونی خود به این طریق ناموفق مانده است این مشکلات را به صورت جدی تری بروز می دهد. بنابراین بیمار پس از بهبود ضایعات پوستی دچار سردرد یا مشکلات گوارشی یا مفصلی می شود.
" هانمان " برای درمان ریشه ای بیمارانش تلاش بسیاری کرد و بالاخره دریافت بهترین دارویی که می تواند بیماری های پوستی بیمارانش را به صورت ریشه ای درمان کند گوگرد است؛ چرا که بیمار پس از درمان مناسب، به مشکلات عمقی تر مبتلا نمی شد و بیماری پوستی اش دیگر هیچ گاه عود نمی کرد. او به تجربه دریافت که مصرف خوراکی گوگرد توان دار شده، می تواند در درمان سایر بیماری ها نظیر آرتروز مفاصل، مشکلات گوارشی، مشکلاتروحی و روانی نیز اثر بخش باشد. تأثیرات مفید گوگرد آن قدر زیاد بود که او کتابی چندین صفحه ای را در این باب نوشت و گوگرد را "شاه داروی هومیوپاتی" نامید.
امروزه با گذشت حدود 200 سال پس از کشف سولفور، پزشکان هومیوپات خوب می دانند که این ادعا بی محل نیست؛ به گونه ای که می توان گفت هیچ فردی در دنیا وجود ندارد که در طول درمان خود دست کم یک بار به گوگرد نیازمند نشده باشد. گوگرد را به راحتی می توان در مواد غذایی شناسایی کرد. بوی بد و تند آن، این عنصر را به یکی از بدبو ترین عناصر تبدیل کرده است. پیاز، سیر، تره کوهی و تمامی گیاهانی که چنین بوی دارند حتما کمی گوگرد را در ساختمان خود دارند. جالب این که ترکیب آن با مواد اسیدی باعث تولید اسید سولفوریک می شود که بویی بسیار متعفن تر و مشمئزکننده تری دارد که همان بوی چاه های فاضلاب است.
در تاریخ آمده است شیخ بهایی از این گاز بد بو و به ظاهر بی فایده برای سوخت حمام خزینه های معروف اصفهان بهره می برده است. او با ساختن سیستمی شبیه اگوی امروزی از چاه های فاضلاب به خزینه حمام توانسته بود روشن بودن دائمی مشعل این خزینه را تضمین کند که باعث حیرت توریست های اروپایی شده بود؛ چرا که آن ها تصور می کردند شیخ بهایی با دانش خود توانسته اتم را بشکافد و به انرژی نامحدودی دسترسی پیدا کند در حالی که این مشعل همیشه روشن گاز اسیدسولفیدریک بود.
گوگرد عنصری است که در جدول تناوبی در زیر گروه اکسیژن قرار گرفته است. این عنصر شناخته شده در بسیاری از مواد آلی و خصوصاً پروتئین ها نقش ساختمانی دارد به گونه ای که وجودش باعث افزایش استحکام پروتئین می شود. این امر باعث می شود بیشتر بافت های محافظتی بدن نظیر پوست،مو و ناخن برای استحکام بیشتر خود از پروتئینی با نام " کراتینین " استفاده کنند که در ساختمان خود حاوی مقادیر زیادی گوگرد است.

جالب آن که افزایش میزان گوگرد در هر کدام از انواع کراتینین ها باعث می شود آن نوع خاص از کراتینین سفت تر و محکم تر شود و این راز استحکام موها و ناخن های شما است. امروزه گوگرد به مدد دانش چندین هزار ساله بشر دوران طلایی خود را سپری می کند.
البته فرم محلول در آب و الکل آن، که به طریقه خاصی توان دار شده باشد بیشترین کاربرد را در طبابت دارد انواع بیماری های پوست، مو و ناخن خصوصا ضایعات پوستی خارش دار، عفونی، انواع مشکلات گوارشی خصوصاً سوزش، نفخ و ترش کردن معده و یبوست، انواع مشکلات مفاصل خصوصاً آرتروز مفاصل، انواع مشکلات روحی و روانی، همه و همه در دورهای از درمان خود تشنه تجویز گوگرد هستند.
اما فرم های دیگر گوگرد نیز در حوزه طبابت کاربرد دارند. امروزه کمتر کسی را می توان یافت که پوست چرب و آکنه ای داشته باشد و در دوره ای از درمان خود از صابون های گوگردی استفاده نکرده باشد. متاسفانه استفاده ناصحیح از این صابون ها باعث شده خواص معجزه آسای آن تحت الشعاع قرار بگیرد چرا که در این صابون ها معمولا پوست فرد را خشک و حساس می کنند، بنابراین افرادی که پوست خشک و تحریک پذیری دارند نباید از صابون گوگرد دار استفاده نمایند. در سایر موارد نیز بهره گیری از این صابون نباید بیش از یک بار در روز انجام شود.
آرایشگران نیز با گوگرد دوستی دیرینه ای دارند؛ چرا که آن ها می دانند ترکیبات گوگرد در صورتی که تحت شرایط خاص با موهای مجعد مشتریان شان در تماس قرار گیرد می تواند فرموهای آن ها را باز کند، هر چند این صافی موقتی است و پس از گذشت چند ماه به حالت اول باز می گردد اما آن قدر خوشایند است که برخی حاضر هستند چند ماه دیگر باز هم برای تجربه این حالت خوشایند به آرایشگران مراجعه نمایند.


کلر یک ماده معدنی است. کلر بوسیله الکترولیز محلول آبداری از کلرید سدیم، تولید میشود. کلر در طبیعت فقط بصورت ترکیب با سایر عناصر یافت میشود. کلر، عنصر شیمیایی مهمی در تصفیه آب، مواد گندزدا در سفید کننده و نیز در گاز خردل بهشمار میرود. همچنین در ساخت طیف وسیعی از اقلام روزمره کاربرد دارد.کلر موجب تحریک دستگاه تنفسی بخصوص در کودکان و کهنسالان میشود.
نام ماده (فارسی): کلر
نام ماده (انگلیسی): Chlorine
نام تجاری (فارسی):کلر
نام تجاری (انگلیسی): Chlorine
مجتمع های تولیدکننده: پتروشیمی شیراز
بوسیله الکترولیز محلول آبداری از کلرید سدیم، کلر تولید میشود. این عنصر در طبیعت فقط بصورت ترکیب با سایر عناصر و عمدتا سدیم به شکل نمک طعام (NaCl) و همچنین در کارنالیت و سیلویت یافت میشود. کلر ( از واژه یونان گرفته شده به معنی زرد مایل به سبز ) را Carl Wilhelm Scheele در سال 1774 کشف نمود و اشتباها تصور کرد، این عنصر حاوی اکسیژن است. Humphrey Davy در سال 1810، نام کلر را برای این ماده انتخاب کرد و اصرار داشت که این ماده در واقع یک عنصر است.
موارد مصرف:
کلر، عنصر شیمیایی مهمی در تصفیه آب، مواد گندزدا، در سفید کننده و نیز در گاز خردل به شمار میرود. همچنین کلر در ساخت طیف وسیعی از اقلام روزمره کاربرد دارد. برای از بین بردن باکتری و سایر میکروبهای موجود در ذخائر آب آشامیدنی بکار میرود. امروزه حتی به ذخائر کوچک آب همواره کلر افزوده میگردد. در تولید محصولات کاغذی، مواد ضدعفونی کننده، رنگدانهها، مواد غذائی، حشره کشها، رنگها، فرآوردههای نفتی، پلاستیک، دارو، منسوجات، حلالها و محصولات مصرفی بسیار زیاد دیگری کاربرد دارد.
مایعات سفید کننده و بهداشتی، صنایع کاغذ و مقوا، تصفیه آب آشامیدنی، ضد عفونی آب استخر و فاظلاب، تهیه کلر و بنزنها، کلر و فنل ها، کلر و پارافین ها، سموم کشاورزی و صنایع شیمیایی از دیگر موارد مصرف کلر می باشد.
در ترکیبات آلی در صورتیکه کلر جایگزین هیدروژن شود، (لاستیک مصنوعی)، اغلب باعث ایجاد خصوصیات مورد نیاز در این ترکیبات میگردد، لذا در ترکیب آلی از این عنصر بعنوان عامل اکسید کننده و جانشین، بطور گسترده استفاده میگردد. سایر موارد کاربرد کلر در تولید کلراتها، کلروفرم، تترا کلرید کربن و در استخراج برم میباشد.
خواص فیزیکی و شیمیایی:
کلر، عنصر شیمیایی با عدد اتمی 17 و نشان Cl میباشد. کلر، هالوژن است و در جدول تناوبی در گروه IV قرار دارد. گاز کلر، زرد مایل به سبز است، دو و نیم مرتبه از هوا سنگینتر، دارای بوی بسیار بد و خفه کننده و بسیار سمی است. این عنصر، عاملی اکسید کننده، سفید کننده و گندزدا میباشد. کلر، بعنوان بخشی از نمکهای طعام و ترکیبات دیگر به مقدار زیادی در طبیعت و لزوما در بیشتر جانداران وجود دارد
Phase gas
Density (0 C, 101.325 kPa) 3.2 g/L
Melting point 171.6 K, -101.5 C, -150.7 F
Boiling point 239.11 K, -34.4 C, -29.27 F
Critical point 416.9 K, 7.991 MPa
Heat of fusion (Cl2) 6.406 kJmol-1
Heat of vaporization (Cl2) 20.41 kJmol-1
Specific heat capacity (25 C) (Cl2) 33.949 Jmol-1K-1
اطلاعات ایمنی:
کلر موجب تحریک دستگاه تنفسی بخصوص در کودکان و کهنسالان میشود. کلر در حالت گازی باعث تورم غشای مخاطی شده و درحالت مایع موجب سوختگی پوست میشود. مقدار 3.5ppm آن لازم است تا به عنوان بویی متمایز شناخته شود و مقدار ppm1000 آن کشنده است. به همین علت در طول وضعیت زندگی استاد درجنگ جهانی اول کلر یکی از گازهایی بود که بهعنوان گاز جنگی مورد استفاده قرار گرفت. مواجهه با این گاز نباید از 0.5ppm فراتر رود.
