
وروجکان مبتکر
شما دانش اموزان عزیز دراین وبلاگ با علوم تجربی نهم آشنا خواهید شد
وروجکان مبتکر
شما دانش اموزان عزیز دراین وبلاگ با علوم تجربی نهم آشنا خواهید شدفصل (2)
برای مشاهده مطالب و فیلم های فصل 2 به ادامه مطلب بروید .

برای دانلود pdf ماده ها و خواص ان اینجا کلیک کنید .
ازمایش زیبا کات کبود

یونها
دید کلی
نیروی پیش برنده یک واکنش یونی ، جاذبه الکتروستاتیکی متقابل یونهای ناهمنام است. این جاذبه باعث آزاد شدن انرژی شبکه میشود. انرژی شبکه، عامل مهمی در تعیین تعداد بار منفی یا مثبتی است که اتمها به هنگام تشکیل یک بلور یونی میپذیرند.
نامگذاری ترکیبات یونی
نامگذاری ترکیبات یونی بر قواعدی چند استوار است. ابتدا از کاتیون (یون مثبت) ترکیب نام برده میشود و آنیون (یون منفی) پس از آن ذکر میشود.
|
|
کاتیون
بیشتر کاتیونها ، یونهای تک اتمیاند که توسط فلزات بوجود میآیند. اگر فلز تنها یک نوع کاتیون ایجاد کند، نام یون ، همانند فلز مربوط است. +Na یون سدیم است. یعنی فلز سدیمی که ابتدا بصورت گازی در آمده است و از سدیم یک الکترون با اعمال انرژی یونش گرفته شده است. 2+Mg یون منیزیم است. 3+Al ،یون آلومینیوم است
 .
.
برخی از فلزات بیش از یک نوع کاتیون بوجود میآورند. در
اینگونه موارد ، با نشان دادن تعداد بار کاتیونها در نامشان آنها را متمایز میکنیم.
بار این نوع کاتیونها بصورت ارقام لاتین بعد از نام فارسی عنصر
قرار داده میشود. +Cu ، یون مس
(I) و 2+Cu
، یون مس (II) است. در روشی
قدیمیتر برای متمایز کردن دو نوع یون بوجود آمده از یک فلز ، پسوندی به نام فلز
افزوده میشود. در این روش ، هرگاه نماد فلزی از لاتین مشتق شده باشد، از نام
لاتین فلز استفاده میشود.
پسوند "-
و"
برای یون دارای بار مثبت کمتر و پسوند "- یک" برای
یون با بار مثبت بیشتر مورد استفاده قرار میگیرد. +Cu ، یون کوپرو و 2+Cu یون کوپریک است. +Fe ، یون فرو و 2+Fe یون فریک
است.
توجه کنید که در روش بالا تعداد بارها بروشنی بیان نمیشود
و نیز این روش برای فلزاتی که بیش از دو نوع کاتیون تولید میکنند، قابل استفاده
نیست.
آنیون
آنیونهای تکاتمی از اتم فلزات به وجود میآیند. نام آنها از طریق حذف بخش آخر نام عنصر و افزودن پسوند "- ید" به باقیمانده به دست میآید. -Cl یون کلرید است. 2-O ، یون اکسید است. 3-N یون نیترید است. اما ، تمام آنیونهایی که نامشان به "ید" ختم میشود تک اتمی نیستند. بلکه معدودی آنیونهای چند اتمی نیز نامشان با این پسوند ختم میشود. مثلا -CN یون سیانید است. -OH یون هیدروکسید است. 2-O2 یون پروکسید است.

آنیونهای چند اتمی بسیاری شناخته شدهاند. بعنوان مثال 2-O2 یون پراکسید ، Cr2O7-2 یون کرومات ، SO3-2 یون سولفیت و 3-AsO4 یون آرسنات است.
یون چند اتمی
این یون ، یونی است
که از چند اتم که با یکدگیر پیوند کووالانسی
دارند، بوجود میآید. کایتونهای چند اتمی معدودند و دو نوع
نمونه متداول عبارت اند از :
- +NH4 یون آمونیوم و 2+Hg2 یون جیوه (I) یا یون مرکورو.
- یون 2+Hg2 یون جیوه I نامیده شده است. زیرا میتوان آن را متشکل از دو یون +Hg (که با یکدیگر پیوند کووالانسی دارند) در نظر گرفت.

پیوند یونی
1- تعریف:
پیوندی را که در نتیجه ی انتقال کامل الکترون میان دو اتم به دست می آید پیوند یونی می نامند.
2-خصوصیات پیوند یونی:
الف- پیوند یونی میان دو اتم که اختلاف الکترونی آنها زیاد باشد(7/1 یا بیشتر)برقرار می شود.
ب- از انجا که در جدول تناوبی فلز ها الکترونگاتیوی کم و نا فلز ها الکترونگاتیوی زیاد دارند پیوند یونی میان فلز ها و نا فلز ها انجام میشود.
ج- در جریان این پیوند اتم های فلزی(دارای یک تا سه الکترون در آخرین تراز خود و گاهی اوقات 4 الکترون) با از دست دادن الکترون های آخرین تراز اصلی خود به یون مثبت (کاتیون) تبدیل می شوند و اغلب به آرایش گاز نجیب قبل از خود می رسند و باید دانست که بار کاتیون به تعداد الکترون های از دسته می گویندکاتیون را با نماد زیر نشان می دهند:
د- اتم های نا فلزی(دارای چهار تا هفت الکترون در آخرین تراز اصلی خود) با گرفتن الکترون به یون منفی (آنیون) تبدیل می شوند و به آرایش گاز نجیب بعد از خود می دانست و بار آنیون مساوی تعداد الکترون های از دست رفته می گویند و آنیون را با نماد زیر نشان می دهند:
س- نیروی ربایش میان یون مثبت و منفی در ترکیب های یونی بسیار زیاد است به همین دلیل ترکیب های یونی در دمای معمولی جامد هستند و به آن «جامد یونی » می گویند.
ص- در جامد های یونی نیروی ربایش میان یون های نا همنام در سه بعد از فضا گسترش می یابد به همین دلیل جامد های یونی شکل های هندسی منظمی دارند که به آنها «بلور یا شبکه بلور» می گویند.
ط- در شبکه بلور هر جامد یونی به ساده ترین واحد تکراری یک بلور «سلول واحد» می گویند به بیان دیگر سلول واحد ساده ترین بخش یک بلور است که تصوی ری از ساختار سه بعدی همه ی شبکه به دست مس آید.
ع- در شبکه بلور جامد های یونی و در سلول واحد آنها هماره تعدادی یون با بار همنام یک یون با بار مخالف را احاطه می کنند.باید دانست که ممکن است سلول واحد جامد های یونی متفاوت از نظر تعداد یون های که یون با بار مخالف را احاطه می کنند اختلاف داشته باشند.این تفاوت به تفاوت نسبی اندازه کاتیونو آنیون بلورهای مربوط است.
ق- در جامد های یونی یون های مثبت و منفی به یکدیگر را می ربایندبه همین دلیل یون ها فقط دارای حرکت ارتعاشی در مکان های خود هستند به همین دلیل ترکیب های یونی در حالت جامد رسانای الکتریسیته نیست ولی در حالت مذاب یا محلول که یون ها آزادی تحرک دارند جریان الکتریسیته را از خود عبور می دهند.
ل- جامد های یونی چکش خوار نیستند .علت این است که بر اثر ضربه ردیفی از یون ها حرکت می کنند و یون ها دارای بار همنام در کنار یکدیگر قرار می گیرند به این ترتیب نیروی دافعه شدید میان آنها به وجود می آیدو شبکه بلور متلاشی می شود.
م- چون نیروی ربایش میان یون های غیر همنام در جامد های یونی بسیار قوی است این ترکیب ها دمای ذوب و جوش بالایی دارند.
3- انرپی پتانسیل و پایداری:
همان طور که می دانیم یکی از عوامل موثر در تشکیل پیوند رسیدن اتم به آرایش هشتایی(آرایش پایدار) اما باید دانست که عامل دیگری در تشکیل پیوند دخالت می کند و آن رسیدن اتم به سطح انرشی پایین تر است.
اتم ها ضمن تشکیل پیوند انرپی ازاد می کنند و به این ترتیب از نظر محتوای انرپی به حالت پایدار تری می رسند به این ترتیب هماره سطح انرپی اتم های تشکیل دهنده آن ترکیب است.
باید دانست در طبیعت آن تغییراتی مساعدند که با کاهش انرپی پتانسیل همراهند. و به طور طبیعی برتری با آن تغییراتی است که پایداری را به حد اکثر می رسانند.
4- انرپی پیوند:
برای غلبه بر نیرو های جاذبه در یک پیوند شیمیایی و جدا کردن اتم ها از یکدیگر باید انرپی صرف کنیم انرپی لازم برای این منظور را انرپی پیوند می نامند و یا به بیان دیگر انرپی پیوند انرپی لاازم برای شکستن یک مول پیوند و تغییر اتم ها از حالت پیوند به حالت آزاد است و بر حسب کیلو پول بر مول بیان می شود.
Or
* باید انست شکستن پیوند همراه با مصرف انرپی همراه است.
* اتم هایی که با یکدیگر پیوند قوی دارند بسیار پایدارند و انرپی لاازم برای شکستن پیوند میان آ نها زیاد است و بالعکس.
5-انرپی شبکه یونی:
انرپی شبکه انرپی آزاد شده به هنگام تشکیل یک مول جامد یونی از یون های گازی مربوط یا مقدار انرپی آزاد شده به هنگام تشکیل بلور یک جامد یونی تعریف می شود.
* انرپی شبکه می تواند معیار خوبی برای اندازه گیری قدرت پیوند در ترکیب های یونی باشد.
* به طور کلی هر اندازه یون کوچکتر باشد و یا بار یون بیشتر باشد انرپی شبکه هم بیشتر است.
* از آنجا که یون ها در ترکیب یونی پیوند های قوی تشکیل می دهندبرای شکستن پیون دها و جدا شدن یون از یکدیگر به ویپه هنگامی که یون ها کوچک باشند به انرپی قابل ملاحضه ای نیاز است اما در برخی از ترکیب ها اندازه یون بزرگ است و به علت ضعیف تر بودن نیروی جاذبه نقطه جوش کمتر می شود.
6-چگونگی تشکیل پیوند یونی:
پیوند میان کلسیم و اکسیژن:
7- چگونگی نوشتن فرمول های شیمیایی ترکیب های یونی دوتایی:
ترکیب های یونی که در ساختار آنها دو عنصر به کار رفته باشد ترکیب های یونی دو تایی می نامند مراحل فرمول نویسی این ترکیب ها به صورت زیر است:
مرحله اول: در سمت چپ نماد شیمیایی کاتیون و در سمت راست نماد شیمیایی آنیون را می نویسیم.
مرحله دوم: بار کاتیون را بصورت زیروند در سمت راست آنیون . بار آنیون را بصورت زیروند در سمت راست نماد کاتیون قرار می دهیم.
مرحله سوم: در صورت امکان زیروندها را بایکدیگر ساده می کنیم و از نوشتن زیر وند یک خودداری می کنیم.
* بسیاری از عنصر های واسطه بیشتر از یک نوع کاتیون تولید می کنند.
* در بین عنصر های واسطه تناوب چهارم اسکاندیم و روی فقط یک نوع یون تولید می کنند.
8- چگونگی نامگذاری ترکیب های یونی دوتایی:
* چنان چه کاتیون مورد نظر دارای دو نوع بار مثبت باشد به هنگام نام گذاری بار کاتیون در ترکیب مورد نظر را با اعداد رمی مشخص می کنیم.
* برای نام گذاری آنیون ها از پسوند « ید » استفاده می کنیم.مانند:
9-عدد اکسایش:
مقدار بار الکتریکی یک اتم در حالت ترکیب است و یا به بیان دیگر مقدار با الکتریکی است که به یک اتم در حالت ترکیب نسبت داده می شود.
قواعد مربوط به تعیین عدد اکسایش:
قاعده اول:عدد اکسایش یک اتم و یا یک عنصر به حالت آزاد عدد صفر است.
قاعده دوم:عدد اکسایش فلوئور در همه ترکیب های آن « 1-» است.
قاعده سوم:عدد اکسایش اکسیپن در بیشتر ترکیب های آن «2-» است.
قاعده چهارم:عدد اکسایش هیدروژن در بیشتر ترکیب های آن «1+» است.
* عدد اکسایش هیدروژن در «هیدرید فلز ها» برابر با «1-» است.
قاعده پنجم:عدد اکسایش فلز ها همواره عددی مثبت است.
قاعده ششم:عدد اکسایش یون های تک اتم با بار یون برابر است.
قاعده هفتم:جمع جبری اعداد اکسایش یک ترکیب خنثی برابر صفر است.
قاعده هشتم:در یک یون چند اتمی جمع جبری عدد اکسایش همه ی اتم های تشکیل دهنده یون با بار یون برابر است.
10- آنیون های چند اتمی:
بعضی از آنیون های چند اتمی از جدا کردن اتم هیدروژن از اسید های اکسیپن دار بدست می آیند بار این آنیون ها مساوی تعداد هیدروژن هایی است که از اسید جدا شده است.
11- چگونگی نام گذاری آنیون های چند اتمی اکسیپن دار:
به ریشه ی لاتین نافلز مرکزی(از اتم اکسیپن صرفنظر می کنیم همچنین اتم هیدروژن را نیز در نظر نمی گیریم)پسوند « ات » اضافه می کنیم.
چنانچه نافلز مرکزی دو نوع آنیون تولید کند(دارای دو نوع عدد اکسایش باشد) در آنیونی که نا فلز مورد نظر عدد اکسایش بالاتری دارد (اکسیپن بیشتری دارد) پسوند« ات » اضافه می کنیم و در آنیونی که نا فلز مورد نظر عدد اکسایش کوچکتری دارد
(اکسیپن کمتری دارد) پسوند «یت» اضافه می کنیم.
* کلر،برم،ید چهر آنیون اسیپن دار تولید می کنند که برای نامگذاری آنها از قاعده زیر استفاده می کنند:
12- ترکیب های یونی چند تایی:
ترکیب هایی هستند که در ساختمان آنها بیش از دو عنصر به کار رفته باشد.
ـ طریقه فرمول نویسی:
مرحله اول: نشانه شیمیایی کاتیون را در سمت چپ و نشانه شیمیایی آنیون را در سمت راست می نویسیم.
مرحله دوم: بار هر یون را به صورت زیر بند در سمت راست یون دیگر قرار می دهیم.
مرحله سوم: در صورت امکان زیر بندها را با یکدیگر ساده می کنیم.و عدد یک را نمی نویسیم.
چنان چه کاتیون مورد نظر جزء کاتیون عنصر هایی باشد که بیش از یک کاتیون دارند باید بار کاتیون را با اعداد رمی و درون پرانتز در جلو نام کاتیون مشخص کرد.

برای دانلود pdf محلول های الکترولیت و غیر الکترولیت اینجا کلیک کنید .

خواص ترکیبات یونی
می دانید که طبقه بندی پیوندهای شیمیایی در شیمی به صورت دو دسته اصلی پیوندهای یونی وکوالانسی است و انواع دیگر پیوند مانند پیوند کوالانسی قطبی و هیدروژنی و یا پیوند فلزی در رده های دیگر پیوند های شیمیایی قرار می گیرد.
در این مطلب می خواهیم به خواصی که پیوندهای یونی از خود نشان می دهند، اشاره کنیم.
دمای ذوب: ترکیبات یونی، دمای ذوب نسبتا بالایی دارند. حتی یک نمک معمولی خانگی (NaCl)، دمای ذوبی در حدود 700 درجه سانتی گراد دارد.
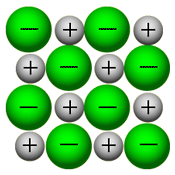
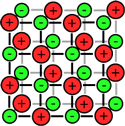
بلور (کریستال) یک ترکیب یونی توسط نیروهای بسیار قوی الکتروستاتیکی، استحکام خود را حفظ می کند، در این حالت، یون های مثبت و منفی همدیگر را جذب می کنند.
یون ها به راحتی در حالت جامد بلور ارتعاش می کنند و زمانی که به بلور یونی، گرما می دهیم تا ذوب شود، این یون ها به راحتی جریان پیدا می کنند.
همان گونه که در شکل سمت راست نیز دیده می شود، یون ها در بلور یونی به صورت بسیار نزدیک و پکیده در کنار هم توسط نیروهای الکتروستاتیکی قرار گرفته اند و برای مثال در بلور NaCl، هر یون با 6 یون با بار مخالف خود احاطه شده است.
در حالت ذوب شده، یون هایی که آزادانه حرکت می کنند، می توانند یک جریان الکتریکی را از طریق خود، هدایت کنند. در حالی که در حالت جامد همین بلور یونی، مکان ثابت و آرایش بسیار کیپ یون ها اجازه هدایت جریان الکتریسیته را نمی دهد.
برای این که ببینید ترکیبات ذوب شده یونی چگونه الکتریسیته را هدایت می کنند، شکل زیر را در مورد الکترولیز نمک طعام ذوب شده ببینید.
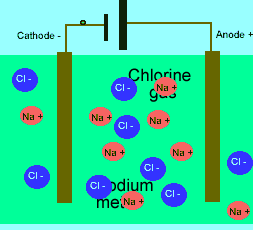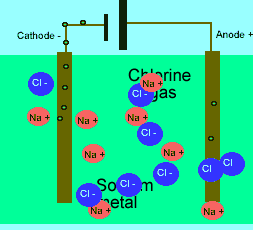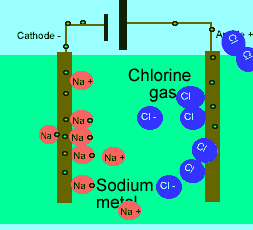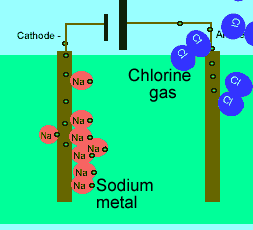
باید بدانید که نیروهای الکتروستاتیکی در شبکه بلوری، در جهت های بسیار ویژه عمل می کنند و همین باعث می شود، ترکیبات یونی بسیار شکننده باشند.
زمانی که یک نیرو به یون های بلور یونی (که یون های آن با بارهای مخالف در کنار هم قرار گرفته اند) اعمال می کنیم (مثلا چکش بر آن فرود می آید)، این یون ها از خط و آرایش قبلی خود خارج شده و نزدیک یون هایی با بار مشابه خودشان قرار می گیرند؛
بنابراین
اکنون نیروی دافعه است که باعث از هم پاشیده شدن شبکه یونی با اعمال یک نیرو (مثل چکش) می شود
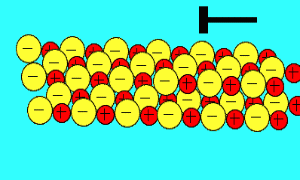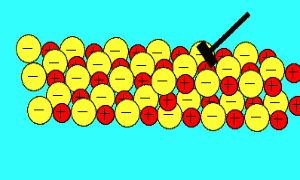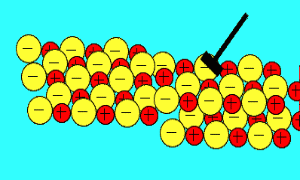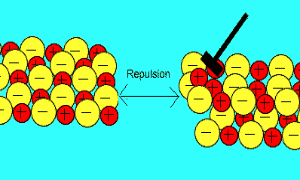 .
.
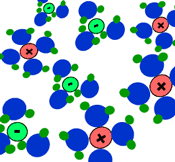
بیش تر ترکیبات یونی، قابل انحلال در آب هستند. در محلول آبی، به دلیل خاصیت از هم جدا کنندگی مولکول های آب، بارهای ترکیب یونی از هم جدا می شوند.
مولکول های آب با مختصر باری که در اتم های اکسیژن(مختصر بار منفی) و هیدروژن(مختصر بار مثبت) دارند، از بین این یون ها حرکت می کنند و جاذبه الکتروستاتیکی بین آن ها را از بین می برند.
مولکول های آب، یون ها را احاطه می کنند و به راحتی از هر نقطه محلول عبور می کنند. اگر ترکیبات یونی در محلول می توانند جریان الکتریکی را هدایت کنند، به دلیل آن است که یون های آزاد (که به راحتی حرکت می کنند)، باعث این کار شده اند.
برای این که حل شدن ترکیبات یونی را ببینید، شکل بالا را تماشا کنید. به این نکته دقت کنید که مولکول های آب چگونه خودشان را به اطراف یون های مختلف در محلول می رسانند.

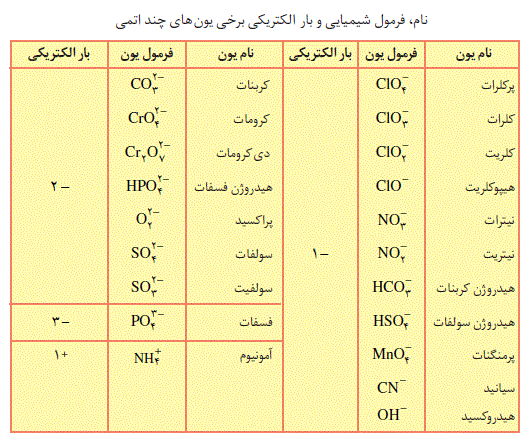
جدول یون ها

ازمایش بسیار جالب حرکت یون ها
